临床试验专业术语整编汇总
刚接触CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的临床试验专业术语: CRO行业的常用术语解释: 1:新药研发
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
为了避免病人和医生在评价治疗结果时的主观因素和偏倚以及安慰剂效应,以便获得可靠的试验数据,临床试险常常要采用盲法进行。设盲(blinding)是指将试验药物和对照品(安慰剂或阳性对照药)均以密码或代号表示,全部试验过程中对病人和/或研究者均保持未知,并由专人或小组保存密码的内容,除非受试病人发生危急情况或安全需要时,否则直到全部试验结束后才公开密码一破盲(unblinding)或揭盲。为此,在设盲时要将试验药物和对照药品(有效已知药品或安慰剂)在剂型、外观、颜色和味道上保持完全一致。在英文文献中 blinding有时也会用 masking这个词代替,尤其是针对眼科治疗药物的试验。
盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技术。下面来具体介绍单盲、双盲、三盲和破盲。

单盲是指受试者不知道自己用的是试验药物还是对照品,但研究者却清楚。
单盲的优点是简便易行,但显然存在很大的缺陷,只是为便于研究者的观察,却很难弥补在试验的严格性方面带来的损失。开放试验或单盲试验由于某些不易控制的因素的干扰,常常会得到偏高的阳性率。如给予精神分裂症病人氯丙嗪后的有效率在23项单盲法试验中为60%,而在12项双盲法试验中仅为38%。再如,据统计在文献报告的72项抗精神病药品的临床试验中,开放性试验获得的阳性率为83%,而双盲对比试验阳性率仅为25%。
双盲是指受试者和研究者都不知道受试者用的什么药。
在双盲试验中,申办者通常会提供给研究者一套随机密封代码并在试验方案中注明破盲的方法和执行破盲的人员,一且发生紧急情况,允许对个别受试者破盲而了解其所接受的治疗,此过程必须在病例报告表上记录井说明理由,然现在已经有如“抽彩卷”那样复杂的扣码方式,但把密码密封在信封内仍是最常用的方法,除非绝对需要,研究者绝不可以随便打开随机码,如果密码被打开了,必须立即通知负责试验的监查员,而且这个受试者也必须退出该试验,所有被打开的密码信封都应在试验结束时送还申办者。
应当说明的是:尽管从理论上讲双盲是可靠的,但是,在实际应用过程中有时也存在一些困难,不能确保“真正”的双盲。例如,有些药物可能会存在一些特殊的味道,病人服用后可能会和安慰剂区别开来,尽管两者的剂型和颜色、外观做的完全一致,再如,有时物理检查结果(如血液的测量)或化验结果(血糖测定),甚至某些药品的代谢产物在尿液中的颜色可能会给研究人员以启示,从而破坏了双盲的严密性,可见,如何在临床试验中确保双盲的严格性是非常重要的,应在研究计划中预先规定。
有时,为了进一步改善双盲的效果,也会用到三盲试验,在该试验中,不仅对受试者和研究者设盲,而且试验的其他有关人员,包括临床试验的监查员、研究助理及统计人员也不清楚治疗组的分配情况。
在三盲试验中,由于统计人员也不清楚设盲的情况,为了进行统计分析,就会涉及两次揭盲的情况。在将所有的临床试验数据输入统计数据库并经过核查,确证准确无误后首先将数据锁定,然后进行第一次揭盲,即首先将所有的病例分为A、B两组,但哪一组是试验组,哪一组是对照组并不清楚。然后进行统计分析,待A组和B组分析数据出来后,再第二次揭盲,即明确A和B分别代表试验组还是对照组。
相比较而言,单盲比开放试验要好,但最严格的试验还是应当采用双盲或三盲进行。应当指出,尽管开放试验不够严格,但在导向试验或危及生命的疾病患者或罕见的疾病,如狂犬病或医学道德不允许设盲的情况下仍需采用该方法。
盲法试验一般在试验结束进行统计分析时才揭盲。但是,为了保障受试者的安全,在紧急情况下,例如发生严重不良事件且又不能判断与试验药物是否有关、过量服药、与合并用药产生严重的药物相互反应等,急需知道服用了何种药物而决定抢救方案时,需要提前破盲。
因此,在试验开始前,申办者除了保存一套完整的随机密码(盲底)外,应当向研究者提供一套密封的盲底备用,在遇到有受试者发生上述紧急情况时可对该受试者进行紧急破盲。破盲后要及时记录提前破盲的时间、原因和执行破盲的人员(签字),同时尽快通知监查员(申办者)。
需要注意的是,破盲一定是发生了严重的不良事件,但是,如果已确定该严重不良事件与试验药物无关,那么就不一定是属于需要破盲的紧急情况。试验者因个人理由面提前退出试验并不需要破盲,更不能因好奇心或其他原因(例如为了改善试验结果)而提前破盲。
一旦提前破盲,该受试者一般就不应继续参加研究,且其试验数据通常不能用于疗效的评价分析,但是仍要列入安全性分析数据集。对受试者还应做好及时的治疗和保护。
物理化学变化往往容易测量,这是因为其结果可严格重复。例如,一段金属棒在每次加热到一定的温度时,测得的膨胀长度总是相同的。另一段同长度的同种金属在加热到相同的温度时,测得的膨胀长度也是相同的,但是生物变化和药品的疗效却并非如此简单。患有同种疾病的不同病人对同种药物治疗的表现可能大不相同,而同一病人在不同时间的表现也可能大相径庭。对药品而言,没有“总是(always)”或“从不(never)”。这就是新药需要正规的临床试验而且必须在双盲对照的条件下得到足够的样本量(sample size)即病例数的主要原因之一。
临床试验必须有足够的把握度(power)来检测不同治疗间的差异。样本应当足够大,才能够对所提出的问题做出可靠的回答。一个临床试验的样本量的大小是由研究的目的、反映研究目的的研究假设和由此导出的统计检验所确定的。
临床试验样本量必须能够满足药品监督管理部门的法规要求,更要能够满足统计学的要求。
我国《药品注册管理办法》规定了化学药各期临床的最低病例数,分别为:Ⅰ期,20~30例;Ⅱ期,不少于100例;Ⅲ期,不少于300例(试验组);Ⅳ期,不少于2000例。但对避孕新药有特殊的要求。生物制品的试验组的病例数为:Ⅰ期,20~30例;Ⅱ期,100~500例;Ⅲ期,200~1000例。
法规要求的病例数可以是最低病例数,但仅仅满足法规要求是不够的,因此需要采用统计学方法确定。
确切地讲,临床试验的样本量应当指完成试验后的样本数目,而不是进入试验的病例数。在制订研究计划时必须考虑到入选和完成的病例数之间可能存在较大的差异及试验过程中病例可能脱落的情况。
利用安慰剂可以使以双盲的方式比较两种外观不同剂型不同的药品的临床试验得以进行。
例如,假设要比较一种剂型为片剂的药品和另一种剂型为胶囊的药品,为了使试验按双盲的方式进行,病人每次服药时,必须要同时服一片药片和一粒胶囊,被分配用药片治疗的病人(甲组)每次要服一片活性药片和一粒安慰剂胶囊,而分配用胶囊治疗的病人(乙组)则每次要服一片安慰剂药片和一粒活性胶囊。
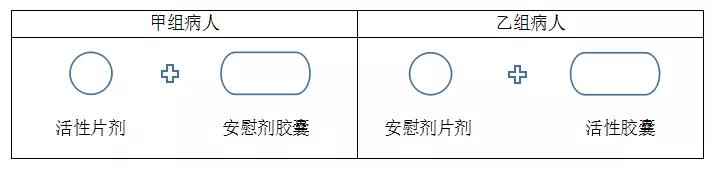
双盲双模拟技术示例
利用该技术可以使病人和研究者均不知道每个病人得到的是何种治疗。该技术常用于对照临床试验中,称为双盲双模拟技术。
摘自北京大学医学出版社出版
《药物临床试验与GCP实用指南》

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

刚接触CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的临床试验专业术语: CRO行业的常用术语解释: 1:新药研发

SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS
试验用药品是指用于临床试验的试验药物、对照药品。试验用药品渗透到了临床试验过程中的每一个步骤,包括药物的生产、包装、运输、保存、使用、回收等。今天我们从临床试验中

不少二三类需要临床的产品,客户一听到临床报价就退缩。既然这么贵,还不如自己做......事实真的是这样吗?临床报价费用都由哪些组成?费用都谁收走了?自己做又有哪些风险?文

俗话说“知己知彼,百战不殆”,对于作为CRC的我们,自认为对CRA其实已经很了解了,但是在我们工作过程有一个角色平时接触不到,但是却又绕不开躲不过,尤其是面对满屏EDC query的

医学的进步是以研究为基础的,这些研究在一定程度上赖于以人作为受试者的试验。--《赫尔辛基宣言》。Ⅰ期临床研究目的是确定可用于临床新药的安全有效剂量与合理给药方案。根据

大多数CRO公司在临床试验现场启动会(SIV)上,常由CRA主导。作为一名有上进心的CRA必须清楚的了解到临床试验现场启动考察的流程,再分享一些本人在启动会考察的细节,请看下文。

在临床试验中,无论是监查员、质控人员或者项目管理人员到研究中心查看项目资料的时候,总会多多少少发现一些问题,有些问题可能大家都比较熟知,但处理手法五花八门的。处理

脱落是每个临床试验中都会出现并且也最让人头痛的现象。但是是什么原因引起脱落而我们怎么才能减少脱落呢?那么我们来谈一下,项目中常见的脱落问题,希望能为各位项目人员提

我国GCP的附录中也列出了类似必备文件,详细内容读者可以参考这两个规范的附录部分。——《药物临床试验与GCP实用指南》......下面介绍研究者应当保存的重要文件及要求。"
行业资讯
知识分享
八年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
