医院院内CRC的管理制度
临床研究协调员(全称Clinical Research Coordinator,简称CRC):指经主要研究者授权,在临床试验中协助研究者进行非医学性的相关事务性工作,是临床试验的参与者。 临床试验现场管理组
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
质量管理体系内审,如何有效的完成?这是很多质量人都曾思考过的问题。今天分享的是一位前辈的经验总结,其中提出的13条方法,非常值得借鉴。

如果我们把工厂当作一个人,那么内审就是针对公司管理体系展开的一个自我批评与自我反省的过程——找到自己的不足,进一步加以改善。与外审结合起来,就是批评与自我批评的过程。如果我们把公司的管理体系当作一件产品,那么它在运行中,也会出现不良与异常,因为外界与内在因素都在不断变化,它们会造成相互影响与相互作用,也会对体系的运行产生变异。
体系的内审就是找到体系的不良与不良发生的原因,并加以纠正、改善,做出纠正预防措施,以达到持续改进最终目的。
一年一次的内审,全厂龙卷风式的一次过。整个公司、所有部门、整个体系进行一次大扫除。走过场,往往很难发现问题。就好像人吃多了,就会消化不良。很多公司的内审主要目的其实只是为了应付外审而不得已为之。很多工厂做内审也是敷衍了事,找不到管理体系的真正问题所在。有时即便找到问题原因,却很少有人跟进,所有东西还是停留在发现问题阶段。
(1)制定审核计划(内容包括:审核目的、审核范围、审核依据、日期、内审人员、日程安排);
(2)制定审核检查表(很多公司没有对审核检查表更新,还是沿用以前的检查表);
(3) 按计划执行审查(执行内部审核,查、看、问、记);
(4)审核结果汇总(召开末次会议,进行结果的汇总);
(5)管理评审(审核结果评估,提出改善意见);
(6)会议决定(定案,决定改善措施,纠正预防措施,负责人,改善计划等);
(7)结果跟进(改善措施的效果跟进,结案)。

除了应付外审的要求之外,还要明确自己的目的性及体系整改目标、部门整改目标、流程整改目标。毕竟组织一次内审是要花费很多时间与精力的,要尽量使它的效能最大化,并且能达到自己的目的,找到真正的不足之处。
比如:觉得自己的装配车间近期合格率直线下滑,我们可以通过内部审核找到它下滑的原因。一些流程走得不顺,效率不佳,我们也可以进行内部调查、测试、审核,找出不顺的原因。
除此之外,还要让相关人员知道,内审不是找谁的茬,是要找管理体系的不足之处,然后加以改正,这是对大家都有好处的。
可以是整个公司、整个体系,也可以是一个部门、一个流程,甚至一个产品的品质控制过程。这些均可以根据内审目的而定。
除了之前的传统体系要求外,我们还可以增加一些有针对性的要求,如:最高管理者的要求、管理者代表的要求、部门负责人的要求。即是与内审的目的相一致。
在审核开始之前主导内审的人员要针对审核的目的与要求,做一些调查与信息的收集,这个在传统内审中是没有的,收集的内容包括:部门内部的绩效表现、人员的调查、负责人的自评、内部人员自评、部门与部门之间互评、日常运行情况。主要目的是使体系内部问题得到初步呈现,了解体系运行中的相关人员对体系运作中的一个感受与评价。这样使后期内审更加有针对性与目的性,效果会更好。这个可以在内审之前的日常管理与进行中积累收集,也可以集体调查收集。
内容包括:审核目的、审核范围、审核依据、日期、内审人员、任务安排、日程安排。使审核工作得到具体的书面上的呈现。
依据调查结果,审核目的的要求确定内审小组成员,可以由有内审员资格的人员,与相关要审核的流程、产品、部门的专业人员陪同,打破传统模式中的只有内审人员参与的方式,这样做的好处是,做到了懂体系的人与懂产品/流程的人相结合。这样做到一个互补。要注意的是,被审核部门的人员需考虑一下避嫌,审核组长可以自行评估利弊。
审核小组成员,针对于审核目的、范围、依据,有针对性地编写审核检查表,突出此次审核的目的是体系的改善还是部门与流程的改善,还是全面的整改与梳理。
检查表出来之后,内审组再一次进行集合评审检查表的内容,剔除多余与重复的审核内容,补充不足之处,批注重点等等。
按照审核计划的内容执行,审核日期可以是随机的,也可以是有计划性的,但一定要尽可能多的发现问题。
结果汇总到审核组长处,并开会讨论分析此次审核发现的问题。汇成书面的审核总结报告交给管代或最高管理者,为下一部的管理评审做准备。如果是单独部门或流程内审,可以在这总结会上讨论并制定相关的纠正预防措施即可,这可以视问题的严重程度灵活运用。
召开管理评审会议,针对审核发现的问题制定相应的纠正预防措施,好的嘉勉,不好改进。
关于管理评审的具体过程我们可以看一下德大公众号之前发的震惊!管理评审竟然可以这样开。(点击题目,查看内容)
使所有的措施得到落实并产生绩效。
所有的措施进行结果跟进与效果评估,形成标准。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

临床研究协调员(全称Clinical Research Coordinator,简称CRC):指经主要研究者授权,在临床试验中协助研究者进行非医学性的相关事务性工作,是临床试验的参与者。 临床试验现场管理组

俗话说“知己知彼,百战不殆”,对于作为CRC的我们,自认为对CRA其实已经很了解了,但是在我们工作过程有一个角色平时接触不到,但是却又绕不开躲不过,尤其是面对满屏EDC query的

脱落是每个临床试验中都会出现并且也最让人头痛的现象。但是是什么原因引起脱落而我们怎么才能减少脱落呢?那么我们来谈一下,项目中常见的脱落问题,希望能为各位项目人员提
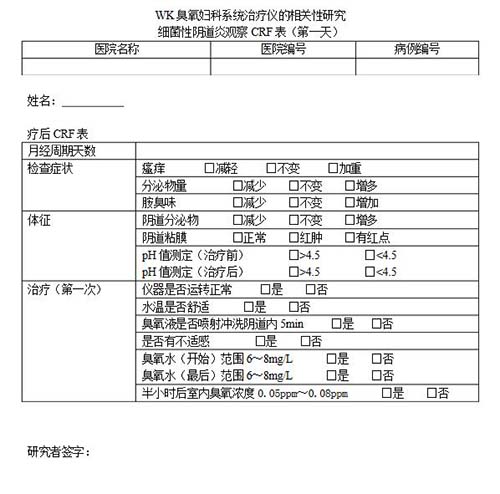
病例报告表(case report form,CRF)是按照临床试验方案的要求设计的书面文件,用于记录和报告每一名受试者在试验过程中的数据,这种文件一般采用表格(纸质或电子)的形式。"

随着越来越多的临床试验中都配备 CRA,CRA 与 CRC 在临床试验中的作用及合作值得大家一起探讨。首先,介绍一下在项目运行中可能出现的问题和矛盾,间接影响了项目的执行和质量。希

作为一名苦逼的CRA,除了日常的监查工作以外,也许还有一个让人很头疼的问题,每次项目会议上PM重复又重复了的话题:“亲,这个Site的进度太慢啦,想想办法啊!CRA:我在想 我在想

方案偏离和方案违背是我们在平时工作过程中,非常容易遇到的一种情况,今天,我们就来聊一下应该 如何做才能更好的降低方案偏离/违背发生呢? 1.定义 其实GCP中并未对方案偏离

临床CCG是什么意思?CCG是数据填写指南,由DM起草,相关人员审核,可能包括PM,医学,药物警戒等,主要是给数据库录入人员CRC.PI.以及发布质疑的CRA和医学使用的指南文件。

在临床试验方案的设计过程中,大家都会尽可能的考虑到各种可能影响试验的因素,并制定标准操作规程,尽量避免和减少在试验中可能出现违背及偏离方案的情况发生,但在试验的执

当今,随着新的GCP法规的全面实施,并伴随着各项监督抽查在全国范围内陆续开展,医疗器械临床试验的各种规定越来越严格了。除了过程中试验的质量必须得到有效的控制外,整个试
行业资讯
知识分享
八年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
