临床试验中的单盲、双盲、三盲、破盲是什么意思?
盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技
来源:医疗器械注册代办 发布日期:2025-06-28 阅读量:次
说说医疗器械注册里一个常见问题。有些企业做完60℃的加速稳定性试验后,觉得产品储运条件不用限定了。这种想法其实不对。加速试验本身是模拟极端环境,通过高温等外部压力快速检测材料退化情况,再推算产品在正常储存下的表现。储运条件直接关系到产品有效期,不管试验多严格,实际储运要求必须明确写出来。下面分步骤说明为什么必须限定储运条件。

加速稳定性试验的操作是把产品放在高温、高湿这些外部压力下,观察材料性能变化。比如60℃高温就是常见的人工加压条件。这么做是因为材料在高温下老化更快,通过测量退化速度,结合阿列纽斯公式(反应速率随温度变化的规律),就能推算出产品在常温下的有效期。简单说,这个试验是“用短期高温模拟长期常温”。
做加速试验时温度是固定的,比如60℃。但产品真实储运环境可能从-5℃到40℃波动。试验只能验证特定高温下的性能,不代表产品能抗住运输中的低温、潮湿或震动。国家药监局器审中心明确说过:储运条件和货架有效期直接挂钩,企业必须根据试验中设定的温度限值(如TRT)来规定储运要求。如果跳过这一步,产品在真实环境下可能提前失效,甚至引发安全问题。
首先看产品特性。比如高分子材料对温度敏感,储运上限最好不超过40℃;金属器械可能耐受更宽范围,但需提供数据支持。其次参考试验参数。加速试验用的温度(如60℃)和推算出的常温有效期,直接决定储运条件的严格程度。最后写进注册资料。储运温度、湿度、避光要求等都要在产品说明书和技术要求里写清楚,不能只写“常温储存”。
国内法规很明确。《无源植入性医疗器械货架有效期注册申报资料指导原则》指出:加速试验是推断正常储存性能的手段,储运条件必须和试验逻辑一致。北京市药监局在审评问答中也强调:只要做了加速试验,储运条件就必须限定,这是注册的基本要求。实际操作中,企业还得实时监测运输中的温湿度,确保符合声明条件。
思途CRO处理过很多这类案例。他们建议分三步:试验前用阿列纽斯公式计算温度系数(Q₁₀),通常取1.8-2.0;试验中监控材料关键性能点,如密封强度或化学降解;试验后结合实时数据交叉验证。哪怕试验温度高达60℃,最终储运条件还得按实际物流环境设定,比如“2-30℃避光运输”。
现在说清楚了吧?加速试验是工具,不是储运条件的替代品。限定条件才能确保产品安全到达用户手中。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技

刚接触CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的临床试验专业术语: CRO行业的常用术语解释: 1:新药研发
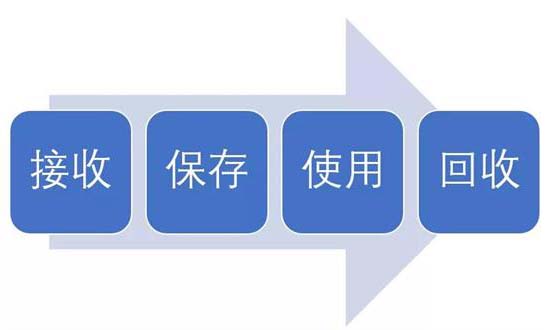
试验用药品是指用于临床试验的试验药物、对照药品。试验用药品渗透到了临床试验过程中的每一个步骤,包括药物的生产、包装、运输、保存、使用、回收等。今天我们从临床试验中

不少二三类需要临床的产品,客户一听到临床报价就退缩。既然这么贵,还不如自己做......事实真的是这样吗?临床报价费用都由哪些组成?费用都谁收走了?自己做又有哪些风险?文

医学的进步是以研究为基础的,这些研究在一定程度上赖于以人作为受试者的试验。--《赫尔辛基宣言》。Ⅰ期临床研究目的是确定可用于临床新药的安全有效剂量与合理给药方案。根据

大多数CRO公司在临床试验现场启动会(SIV)上,常由CRA主导。作为一名有上进心的CRA必须清楚的了解到临床试验现场启动考察的流程,再分享一些本人在启动会考察的细节,请看下文。

在临床试验中,无论是监查员、质控人员或者项目管理人员到研究中心查看项目资料的时候,总会多多少少发现一些问题,有些问题可能大家都比较熟知,但处理手法五花八门的。处理

我国GCP的附录中也列出了类似必备文件,详细内容读者可以参考这两个规范的附录部分。——《药物临床试验与GCP实用指南》......下面介绍研究者应当保存的重要文件及要求。"
随机化被奉为临床试验设计的三大基本原则之一,随机临床试验被视为临床试验的“金标准”,所产生的证据被循证医学界确定为高等级证据。对于医疗器械临床试验,2018年1月由CFDA发

2019-12-01药物临床试验机构(简称机构)开始实行备案管理。本文结合机构备案平台构建思路,着重介绍了备案平台的结构组成以及相关要求,梳理了机构备案过程中的常见问题,对机构
行业资讯
知识分享
八年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
