CRA如何提高受试者入组效率?这四个容易忽略的问题要搞清楚
作为一名苦逼的CRA,除了日常的监查工作以外,也许还有一个让人很头疼的问题,每次项目会议上PM重复又重复了的话题:“亲,这个Site的进度太慢啦,想想办法啊!CRA:我在想 我在想
来源:医疗器械注册代办 发布日期:2022-04-26 阅读量:次
思考:受试者为新疆维吾尔族人,仅会维吾尔语,有知情能力,但无法使用汉语进行书写、沟通及交流,此患者是否可以入组临床试验?
1、随着时间的推移,要求受试者可流利使用英文的临床试验数量在NCT上登记的比例越来越高[1]。

2、英文水平有限的人群在美国人口的比例也越来越高,但在临床研究中参与不足,这本质上限制了此类研究的社会效益及科学研究的普遍性,如果限制了语言,也就限制了社会公平及伦理效应[2]。

IRB/IEC一方面从伦理角度出发,支持在临床试验中纳入语言受限的受试者以及保护其权益;一方面从公平公正角度出发,临床试验应当确保对社会各群体公平参与,不应以医学或科学上不相关的特质(语言受限)而剥夺此群体参与临床试验受益的机会[3]。
另一个考虑源于招募多样化和有代表性人群的重要性,这确保了研究结论可以广泛地推广到社会的各个阶层,虽然语言受限者本身不是一个科学相关的变量,但它可能与这些特征重叠,包括增加的并发症及合并用药,因为不幸的事实是:语言受限者更可能在经济及社会地位处于弱势,更容易受到健康相关的负面社会因素的影响[4]。
1、招募非英语受试者是研究人员保证临床研究多样性的常见方式。FDA及OHRP(美国卫生部人类研究保护办公室)法规鼓励这样操作,以确保受试者选择的公平性[5-7]。
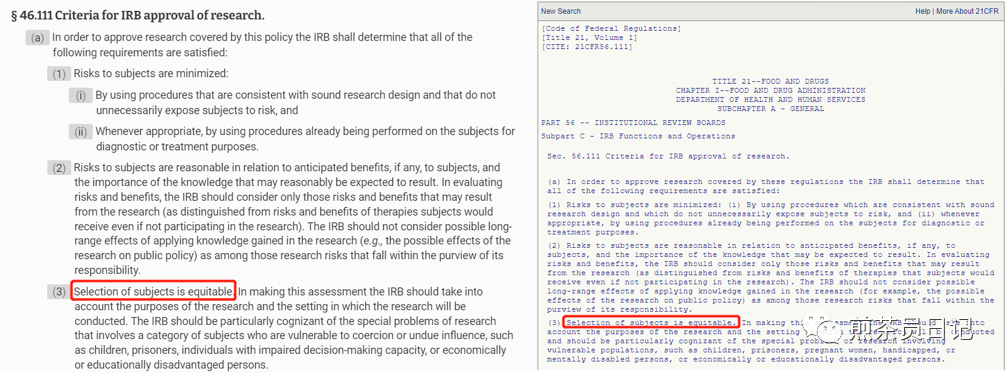
2、不幸的是,联邦对非英语人士的指导是有限的,主要集中在知情同意书上。信息必须以“受试者可以理解的语言”呈现[8],并且在大多数情况下,“知情同意书应以书面形式记录”[6,9]。

3、申办者和研究人员应该预测他们可能会遇到哪些非英语人群参加试验,并主动同意将相关材料翻译成这些语言。IRB也应该确定翻译的准确性,可以通过第三方翻译公司服务或其他认证的翻译的证明来完成。研究者还应要求去与IRB的相关记录核对,以确保他们符合IRB翻译文件的要求[4]。
4、FDA法规还针对无法取得ICF翻译文件的意外情况做出具体规定。在这种情况下,研究人员可以使用所谓的“Short form”同意书,并与口译员一起进行同意过程。简短的同意书是一份包含研究的关键要素的文件,要被翻译成受试者的母语。但是由于“Short form”不包含研究的特定信息,因此通过这种方式入组的受试者最好尽快获得完整的ICF翻译,并再次进行知情[9-11]。
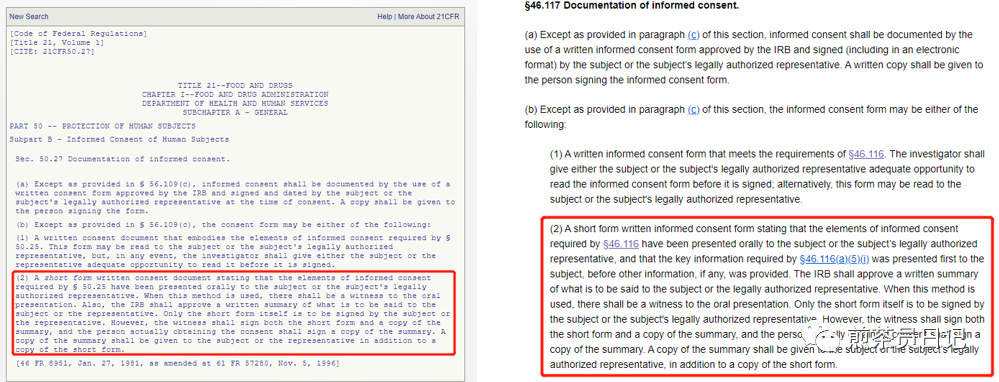
5、这个“Short form”要说明§ 46.116要求的知情同意要素已经口头告知受试者(或其法定代理人)。
6、§46.116(a)(5)(i)要求的关键信息要在提供其他信息前先告知受试者。
7、IRB应该批准向受试者提供的”Summary”(未翻译的ICF可以作为Summary)。
8、口头陈述应当有公正见证人。
9、如何签字:
a) 知情同意书(summary):研究者、公正见证人
b) Short form:受试者(或其法定代理人,后面略)、公正见证人
10、文件如何归属:
a) 知情同意书(summary):
(1)原件:研究者、公正见证人
(2)签署完成的复印件:受试者
b) Short form:
(1)原件:受试者、公正见证人
(2)签署完成的复印件:研究者

口译员:为所有研究访视配备口译员有助于受试者更好的理解研究并参与(避免临时使用)
(1)口译员与笔译员不同:笔译员是将书面内容转换为读者的母语;而口译员则以非英语使用者可以理解的语言解释口语信息。
(2)与口译员合作时,应考虑询问此人的证书,许多州都有医疗口译员协会,此协会会提供认证医疗口译员(CMI)证书。
(3)研究者还需询问口译员在临床研究方面的经验。大部分口译员都熟悉临床程序和术语,但并非所有口译员都了解临床研究的独特差异。
(4)受试者的朋友或家人可以担任口译员,但是鼓励使用公正的口译员(可兼做公正见证人),而不是家人或朋友。就像其他口译员一样,他们需要解释潜在的复杂的术语。
(5)儿童不能当口译员[11]
(1)能够流利使用受试者母语及ICF使用的语言
(2)无利益相关
(3)口译员可以作为公正见证人
对于非英语受试者,FDA指南和相关法规仍有未尽事宜。知情同意书只是知情同意过程的一部分,研究者还需对其他情况做好准备,需要不断进行受试者教育及告知新的信息[6]。
(1)伦理审查申请表中说明将招收语言受限者,EC批准后才可入组
(2)明确谁将执行知情同意程序,以及整个研究中此人如何与语言受限者交流使用
(3)合格的口译员来保证知情同意过程
(4)研究者有责任判断参与者对知情同意信息的理解
以下是使用首选(Preferred)或简表(Short Form)法的思维导图:


随着国际化交流日渐频繁,后续在国内开展的Local临床试验可能不仅仅会入组中国本土受试者。
虽然考虑到对申办者和CRA的时间、经济成本,但仅仅因为语言因素限制受试者入组,这并不是最佳的解决办法。
如何更好的为患者带来获益,值得我们不断去思考和探索,这样才能体现临床试验的包容性和多样性,欢迎大家留言区一起讨论~
[1] Egleston, B. L. , et al. "Characteristics of clinical trials that require participants to be fluent in English." Clinical Trials (2015):1740774515592881.
[2] Glickman, Seth W. , et al. "Perspective: The case for research justice: inclusion of patients with limited English proficiency in clinical research. " Academic Medicine Journal of the Association of American Medical Colleges 86.3(2011):389-93.
[3] 小Z, “语言受限受试者的知情同意考虑”, 公众号:临研杂货铺(2022-04-08)
[4]https://www.advarra.com/blog/research-equity-and-enrolling-non-english-speakers
[5] FDA 45 CFR 46.111
[6]https://www.advarra.com/blog/non-english-speaking-research-subjects-whats-regs/;
[7] FDA 21 CFR 56.111
[8] FDA 45 CFR 46.116
[9] FDA 45 CFR 46.117
[10] FDA 21 CFR 50.27
[11] HHS OHRP: https://www.hhs.gov/ohrp/regulations-and-policy/guidance/obtaining-and-documenting-infomed-consent-non-english-speakers/index.html
[12]https://irb.ucsf.edu/consenting-non-english-speakers#interpreter
作者:风起青萍之末

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

作为一名苦逼的CRA,除了日常的监查工作以外,也许还有一个让人很头疼的问题,每次项目会议上PM重复又重复了的话题:“亲,这个Site的进度太慢啦,想想办法啊!CRA:我在想 我在想

通过电话或面对面进行潜在受试者的预筛选,以确定受试者最初的合格性和其对研究的兴趣是招募过程中常见的策略。需要注意的是在使用此策略时,研究者必须保护潜在受试者的隐私

大家在项目中,是否遇到过ICF更新的情况?在ICF更新后,已由受试者签署的知情同意书,是否需要重新签署呢?又有哪些情形不需要重新签署呢?本期我们继续跟大家分享知情同意书实

NCCN(美国国立综合癌症网络)指南是目前国际上最权威、最广泛采用的癌症治疗指南。NCCN指南明确指出: 治疗选择之一就是参加临床试验 。 在欧美国家很多患者会主动咨询医生是否

招募广告是临床试验中用以招募受试者的一种方法,随着药物、器械临床试验以及研究者发起的涉及人的生物医学研究越来越广泛地开展,临床试验中招募广告的使用也日益频繁,甚至

临床数据管理员(DM)能力和要求?数据管理员在整个临床研究中要密切注意研究中的关键变量的数据质量,确保它们百分之百准确无误。此外,临床研究方案还应该对试验的质量控

知情同意对从事临床的CRC来说,并不陌生。日常工作中每时每刻都在与临床试验受试者沟通交流,那么你知道知情同意书签署注意事项及核查要点吗?我们先来区分知情同意和知情同意

受试者招募定义: 招募合适的受试者进入临床试验。根据临床研究方案要求,通过招募潜在的符合方案入选标准不符合排除标准要求的受试者,并向研究者推荐,达到加快入组速度的目

儿童受试者属于弱势群体(vulnerable subjects),参加临床试验时,应给予更多的保护和尊重。前两天分析了临床项目管理中的进度管理,今天和大家深度讨论儿童受试者知情同意的年龄问

作为任何领域项目的项目经理(PM),回顾项目管理圣经PMP,三大基本要素——时间、成本、质量的理解必须深刻。涉及时间这个要素的具体体现就是进度。PM片面意义上可以粗俗的理解
行业资讯
知识分享
八年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
